De toelating voor het in de handel brengen van een GGO's wordt op het niveau van de Europese Unie uitgereikt. Deze toelating impliceert immers het vrije verkeer van de producten toegelaten in de hele Europese Unie en dus zijn alle lidstaten betrokken.
Afhankelijk van het beoogde gebruik(en) van het GGO kunnen twee procedures toegepast worden:
- Geen gebruik als levensmiddelen of diervoeder: In de handel brengen onder Richtlijn 2001/18/EG
- Gebruik als levensmiddelen of diervoeder: In de handel brengen onder verordening (EG) 1829/2003
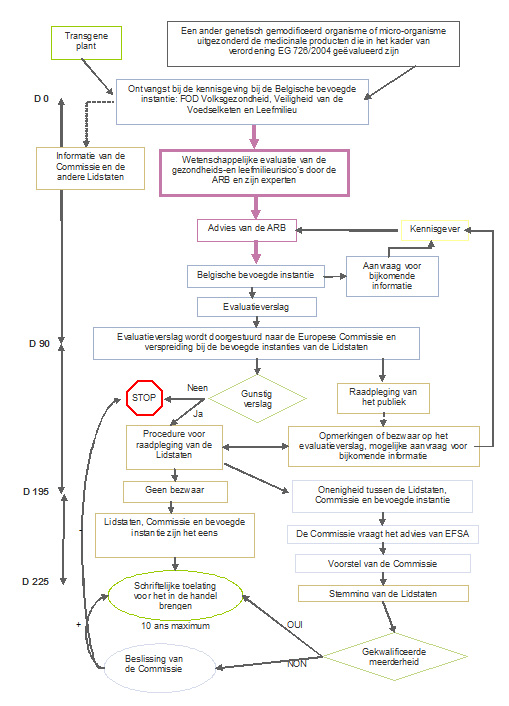
Procedure 1: In de handel brengen onder Richtlijn 2001/18/EG
(alleen van toepassing indien het toepassingsgebied van de kennisgeving geen betrekking heeft op gebruik als levensmiddelen of diervoeders)
Voorbeelden: GGO's vrijgegeven in het leefmilieu voor industriële doeleinden (bvb. GG bomen voor de papier- of zetmeelindustrie), voor de productie van energie (biobrandstoffen), voor zuivering (bvb. genetisch gemodificeerde micro-organismen om verontreinigingen af te breken), voor de verbetering van het landschap, voor de versiering ovv snijbloemen (bvb. GG anjers), of voor ongediertebestrijding (bvb. GG steriele insecten).
De procedure voor de toelating is gebaseerd op een wisselwerking tussen de nationale autoriteiten en de Europese Commissie, waarbij een nationale fase wordt gevolgd door een communautaire fase. De aanvrager dient zijn toelatingsaanvraag in bij de nationale bevoegde autoriteit van een EU-lidstaat. Deze lidstaat (lead country) wordt de "rapporteur" voor dit dossier en verricht een eerste evaluatie van het betrokken dossier.
Parallel wordt de samenvatting van de kennisgeving (“SNIF - summary notification information format”) doorgestuurd naar de Europese Commissie, die het voor het publiek beschikbaar maakt.
|
Een kennisgeving voor een aanvraag tot het op de markt brengen is een zeer complex dossier. Het moet alle informatie bevatten, zoals aangegeven in Art 13 van Richtlijn 2001/18/EG, met in het bijzonder:
|
De lead country stelt een beoordelingsrapport op en stuurt het naar de Europese Commissie, die het doorstuurt naar de lidstaten voor commentaar. In dit stadium wordt een beoordelingsprocedure uitgevoerd op EU-niveau, waarbij de andere lidstaten opmerkingen, bezwaren of verzoeken voor nadere informatie over de kennisgeving kunnen indienen. Indien bezwaren worden gemaakt en behouden, vraagt de Commissie om het advies van de Europese Autoriteit voor Voedselveiligheid (EFSA).
Bijdragen van de Bioveiligheidsraad en de SBB
Indien België gekozen wordt als lead country voor een toepassing, is de Bioveiligheidsraad verantwoordelijk voor de uitvoering van de risicobeoordeling (zie hoofdstuk “enkele cijfers”).
De voornaamste dossiers die door België in het kader van de Richtlijn 2001/18/EG (en voorheen in het kader van de Richtlijn 90/220/EEG) worden behandeld, zijn dossiers die via andere lidstaten zijn ingediend (zie ook hoofdstuk “enkele cijfers”). De beoordeling van deze dossiers is in de meeste gevallen uitgevoerd door de SBB onder mandaat van de Bioveiligheidsraad. De SBB draagt op twee niveaus bij aan de risicobeoordeling:
- zodra het evaluatierapport door de rapporterende lidstaat wordt overhandigd, beschikken de andere lidstaten over een termijn van 60 dagen om eventuele opmerkingen en bezwaren te formuleren;
- als er bezwaren zijn, wordt de kennisgever verzocht bijkomende informatie te geven, waarna de lidstaten opnieuw 45 dagen de tijd krijgen om hun bezwaren te handhaven of op te heffen.
Op basis van het beoordelingsrapport en eventueel het advies van de EFSA, stelt de Europese Commissie voor aan de lidstaten om de toestemming te verlenen of te weigeren. Een gekwalificeerde meerderheid is vereist om het voorstel van de Commissie goed te keuren. Indien een gekwalificeerde meerderheid niet kan worden bereikt tussen de lidstaten (eerst in het regelgevend comité op grond van Richtlijn 2001/18/EG, daarna bij een Appeal Committee), wordt de definitieve beslissing door de Commissie genomen.
De toestemmingen worden voor maximaal tien jaar verleend en zijn verlengbaar.
Onder de nieuwe Richtlijn (EU) 2015/412 hebben de lidstaten de mogelijkheid de teelt van GGO's te beperken of te verbieden op hun grondgebied, hetzij tijdens de vergunningsprocedure, hetzij nadat een GGO is toegelaten voor de teelt in de EU.
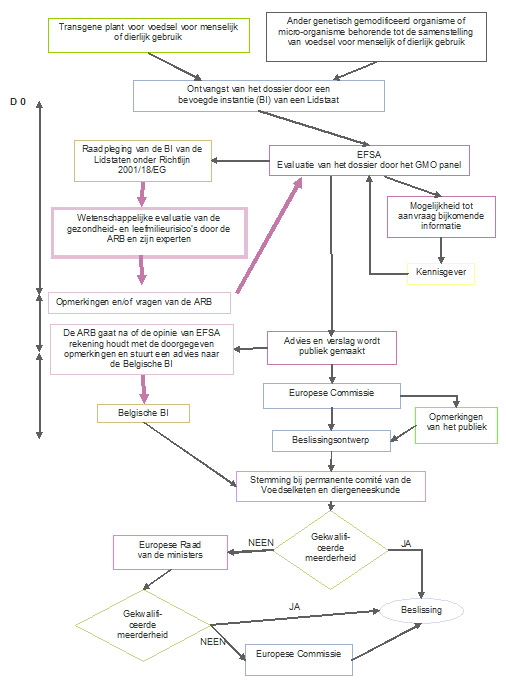
Procedure 2: In de handel brengen onder verordening (EG) 1829/2003
(verplicht wanneer het toepassingsgebied van de kennisgeving het gebruik als levensmiddel of diervoeder inhoudt)
Voorbeelden: Genetisch gemodificeerde gewassen gebruikt als voedsel en / of diervoeders; Enzymen, additieven, vitaminen en smaakstoffen voor gebruik in levensmiddelen of diervoeders, die bestaan uit of zijn geproduceerd met GGO's (met inbegrip van genetisch gemodificeerde micro-organismen); Biomassa gebruikt als veevoeder.
Het in de handel brengen van genetisch gemodificeerde voedingsmiddelen voor de mens of voor dieren wordt door de Verordening (EG) 1829/2003 geregeld. De dossiers hebben betrekking op hetzij nieuwe GGO's, hetzij op de verlenging van de toelating ingediend overeenkomstig artikel 11 van de Verordening betreffende GGO's die voorheen zijn toegelaten in het kader van de Richtlijn 90/220/EEC of de Verordening (EG) 258/97 en waarvan de termijn afloopt.
De procedure voor de beoordeling van de risico's wordt gecentraliseerd. De aanvraag wordt aanvankelijk bij een lidstaat ingediend maar het dossier wordt onmiddellijk doorgegeven aan de Europese Autoriteit voor voedselveiligheid (EFSA), die voor de wetenschappelijke evaluatie zorgt.
Als het toepassingsgebied van de aanvraag ook de teelt van het GGO omvat, heeft de kennisgever de mogelijkheid om de aanvraag in te dienen (i) alleen onder de verordening (EG) 1829/2003, of (ii) onder de Richtlijn 2001/18/EG (voor aspecten betreffende het kweken) en de verordening (EG) 1829/2003 (voor voedingsgebonden aspecten). De kennisgevers hebben tot nu toe altijd de voorkeur gegeven aan de eerste optie. Wanneer het toepassingsgebied van een aanvraag op grond van Verordening (EG) 1829/2003 ook de teelt omvat, besteedt de EFSA de milieurisicobeoordeling uit aan een EU-lidstaat, die de EFSA zijn Environmental Risk Assessment (ERA) rapport toestuurt.
|
Een aanvraag tot toelating voor een GGO voor gebruik als voedingsmiddel of diervoeder moet aan bepaalde eisen beantwoorden, zoals aangegeven in Verordening (EG) 1829/2003, alsook in Uitvoeringsverordening (EU) 503/2013 van de Commissie. De EFSA heeft tevens richtlijnen opgesteld, bedoeld om de kennisgevers te helpen bij het opstellen van een kennisgevingsdossier voor GG planten, bestemd voor gebruik als voedingsmiddel of veevoeder, voor de invoer, de verwerking en/of de teelt in de EU in het kader van Verordening 1829/2003. |
De EFSA voert de risicobeoordeling uit en publiceert in de EFSA Journal een opinie over de toepassing, ter attentie van de Commissie en de Lidstaten. Deze risicobeoordeling worden door het GGO Panel van de EFSA uitgevoerd, dat bestaat uit onafhankelijke wetenschappelijke experten ondersteund door gespecialiseerde werkgroepen. EFSA voert de risicobeoordeling uit en publiceert in de EFSA Journal een opinie over de toepassing, ter attentie van de Commissie en de Lidstaten. Deze risicobeoordeling worden door het GGO Panel van de EFSA uitgevoerd, dat bestaat uit onafhankelijke wetenschappelijke experten ondersteund door gespecialiseerde werkgroepen.
De opinie van de EFSA wordt tevens vrijgegeven voor het grote publiek, dat over 30 dagen beschikt om commentaar te geven via de ad hoc site van de Commissie. Theoretisch gezien moet de EFSA een opinie opstellen binnen zes maanden na de ontvangst van een aanvraag, maar in de praktijk duurt het meestal veel langer voor de EFSA een finaal advies opstelt. Dit komt doordat het officiële tijdsverloop van de aanvraag stopgezet wordt tussen het moment dat de EFSA bijkomende vragen stelt aan de kennisgever, of om bijkomende experimentele resultaten vraagt, en het moment dat het de antwoorden ontvangt.
De verordening "GG voedsel" voorziet in een bijdrage van de Lidstaten in de risicobeoordeling (Art 6.4). De Lidstaten mogen observaties, commentaar en vragen over de dossiers opsturen naar EFSA tijdens een consultatieperiode van 90 dagen (verplichte consultatieprocedure voor de bevoegde overheden, voorzien door Richtlijn 2001/18/EG). Wanneer EFSA uiteindelijk zijn opinie publiceert, moet het ook in bijlage de lijst van alle vragen en commentaar van alle Lidstaten meegeven, alsook de antwoorden van de GMO Panel op iedere vraag.
Bijdragen van de Bioveiligheidsraad en de SBB
De Bioveiligheidsraad neemt, met de wetenschappelijke steun van zijn externe deskundigen en de SBB, deel aan de consultatieprocedure van 90 dagen voor alle GGO-dossiers. Dossiers met betrekking tot bijproducten (bloem, olie, suiker, …) worden niet door de Raad geëxpertiseerd.
De Raad heeft ook de “environmental risk assessment” van drie GG maïs-dossiers behandeld (zie hoofdstuk “enkele cijfers”).
De bevoegde minister heeft sinds 2005 aan de Raad de opdracht gegeven om advies te verlenen ter aanvulling van de finale opinie die door de EFSA wordt gepubliceerd, en dit voor alle dossiers die via de verordening "GG voedingsmiddelen" worden ingediend. Dit advies heeft betrekking op alle aspecten van de kennisgeving (moleculaire karakterisering, impact op het leefmilieu, voedings- en compositionele analyse, toxiciteit en allergeniciteit). Het is voornamelijk op basis van dit advies en de opinie van de EFSA dat de Belgische overheden hun positie over de ontwerpbesluiten van de Europese Commissie bepalen.
Op basis van het advies van het EFSA, stelt de Europese Commissie voor aan de lidstaten om de toestemming te verlenen of weigeren. Een gekwalificeerde meerderheid is vereist om het voorstel van de Commissie goed te keuren. Indien een gekwalificeerde meerderheid niet kan worden bereikt tussen de lidstaten (eerst in het Standing Committee on Plants, Animals, Food and Feed, daarna bij een Appeal Committee), wordt de definitieve beslissing door de Commissie genomen.
De toestemmingen wordt voor maximaal tien jaar verleend en is verlengbaar.
